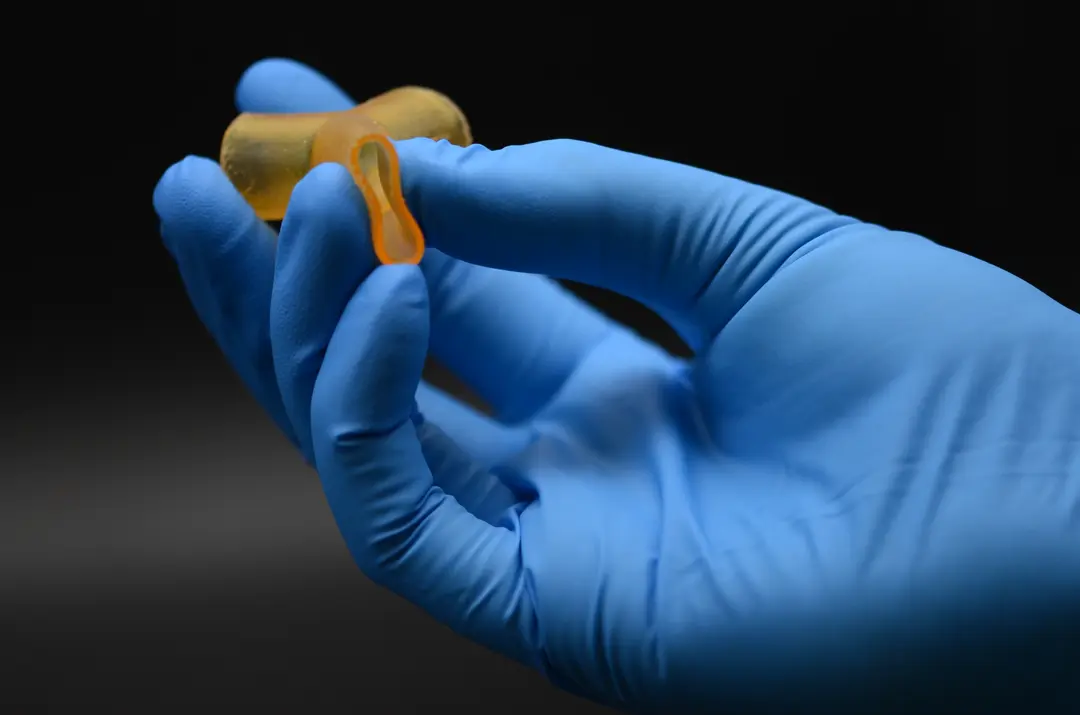
Comment l'impression 3D accélère les recherches en ingénierie tissulaire à l'Université de Sheffield
Bien que le corps humain soit la machine la plus sophistiquée au monde, ses capacités d’auto-réparation sont limitées. En cas de blessure ou de maladie, la plupart de nos tissus et organes sont incapables de se régénérer et de retrouver leur état d'origine.
Notre système vasculaire est constitué d'un réseau de tubes complexes qui servent au transport des nutriments et de l'oxygène dans le corps. Les dommages ou les blocages dans ce réseau peuvent réduire l'apport sanguin essentiel et entraîner des complications majeures telles que des accidents vasculaires cérébraux ou des crises cardiaques.
Les traitements conventionnels des maladies cardiovasculaires reposent sur des autogreffes. Il s’agit de prélever un vaisseau sanguin à un endroit moins vital du corps du patient et de l’utiliser pour réparer ou contourner un vaisseau endommagé ou bloqué plus important. Par exemple, récolter une veine de la jambe du patient et l’utiliser pour contourner une artère coronaire qui alimente le cœur en sang.
Cependant, la disponibilité des autogreffes est limitée et leur obtention nécessite une intervention chirurgicale invasive. Des greffons vasculaires synthétiques en matériaux polymères sont également disponibles, mais ils sont sujets aux infections et à la coagulation du sang, en particulier dans les vaisseaux de très petits diamètres. C’est là que l’ingénierie tissulaire entre en jeu.
L'ingénierie tissulaire est le développement de technologies permettant de produire en laboratoire des tissus et des organes de remplacement destinés au traitement des blessures et des maladies. Cette technique utilise des cellules prélevées sur le patient à traiter, ce qui élimine la possibilité de rejet par le système immunitaire, ce qui est un problème majeur dans les procédures classiques de transplantation d'organes.
Au cours des dernières années, des progrès considérables ont été réalisés dans la production de vaisseaux sanguins grâce à l’ingénierie tissulaire, mais les chercheurs ont seulement pu construire de simples tubes droits. Le réseau vasculaire est complexe, avec des coudes, des conicités et des branches, et recréer ces formes reste un défi.
Dr Sam Pashneh-Tala de l'Université de Sheffield relève ce défi. Ses recherches utilisent l’impression 3D par stéréolithographie (SLA) de bureau de haute précision pour permettre la production de vaisseaux sanguins par ingénierie tissulaire avec une variété de géométries. Cela permettra de concevoir des greffons vasculaires spécifiques au patient et d'améliorer les options chirurgicales et fournira une plate-forme de test unique pour de nouveaux dispositifs vasculaires destinés aux personnes souffrant de maladies cardiovasculaires, ce qui est actuellement la première cause de décès dans le monde.

Bio-impression et impression 3D en génie tissulaire
La flexibilité et la précision de l'impression 3D en tant que technique de fabrication se prêtent naturellement à l'ingénierie tissulaire. Les tissus qui composent notre corps sont un arrangement 3D complexe de cellules et de protéines structurelles, mais ils sont également très variables, chaque corps étant unique.
Des méthodes d'impression de cellules directement en 3D pour former des tissus et des organes sont en cours de développement. Cela peut sembler être de la science-fiction, mais cela se produit vraiment, en ce moment. Ces techniques de « bio-impression » peuvent reproduire la géométrie d'un tissu naturel. Cependant, recréer ses performances mécaniques et biologiques est plus difficile.
Une approche alternative consiste à orienter la croissance des cellules pour qu’elles forment le tissu requis en laboratoire. La plupart des cellules cultivées in vitro ne s'organisent pas naturellement en structures 3D. Pour ce faire, les cellules peuvent être cultivées sur un échafaudage, ce qui donne un modèle de la forme requise. Par exemple, un échafaudage tubulaire peut être utilisé pour produire un vaisseau sanguin. Les cellules vont se multiplier et recouvrir l'échafaud, prenant ainsi sa forme. Au fil du temps, l’échafaudage se décompose, ne laissant que les cellules disposées dans la forme du tissu cible.
Le Dr Pashneh-Tala utilise une approche hybride, l'impression 3D lui permet de produire des échafaudages d'ingénierie tissulaire pour la croissance de vaisseaux sanguins présentant des géométries uniques. Ces échafaudages sont ensuite ensemencés avec des cellules et cultivés en laboratoire.
Jusqu'à présent, la recherche en ingénierie des tissus vasculaires s'est concentrée sur la production de vaisseaux droits. Ceux-ci ne sont pas en mesure d'imiter avec précision l'architecture des vaisseaux retrouvés dans le corps et imposent donc des limitations aux chirurgiens vasculaires. L'impression 3D est la technologie idéale pour s'attaquer à ce problème, et le Dr Pashneh-Tala est capable de créer des formes organiques et personnalisées sans frais supplémentaires.
« Ce qui me différencie est que je suis capable de créer des vaisseaux sanguins avec des géométries au plus proche de celles trouvées dans le corps. Cela offre la possibilité d'améliorer les options chirurgicales et même de concevoir des vaisseaux sanguins adaptés au patient. Sans accès à une impression 3D abordable et de haute précision, la création de ces formes ne serait pas possible. »
Dr Sam Pashneh-Tala, Chercheur, Université de Sheffield
Fabrication d'échafaudages : en un coup d'œil
- Spécifier la forme de l’échafaudage et créer un modèle CAO du négatif du moule pour l’échafaudage.
- Imprimer en 3D le négatif du moule d'échafaudage à l'aide de la technologie SLA de bureau.
- Imprimer les négatifs des moules en 3D avec du silicone et les polymériser pour obtenir les moules d'échafaudage.
- Assembler les moules d'échafaudage en silicone.
- Injecter le matériau d'échafaudage (émulsion polymère biodégradable) et photopolymériser pour créer un échafaudage solide et poreux.
- Stériliser l'échafaudage et l'ensemencer avec des cellules.
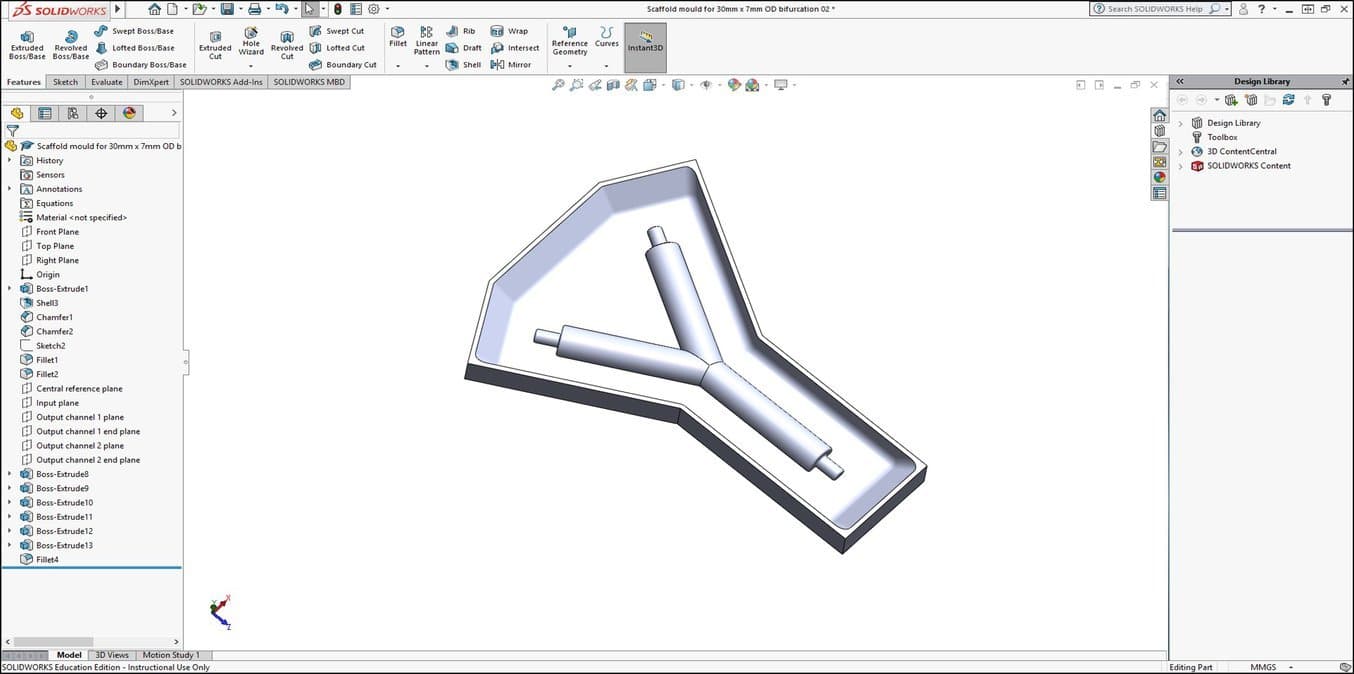
1. Spécifier la forme d'échafaudage et créer un modèle CAO du négatif de moule d'échafaudage
Le Dr Pashneh-Tala utilise l'impression 3D et le moulage en silicone pour fabriquer les moules destinés à la fabrication de ses échafaudages d'ingénierie tissulaire. Travaillant à reculons depuis la conception de l'échafaudage souhaitée, un négatif du moule qui façonnera l'échafaudage est conçu avec le logiciel de CAO SolidWorks®.

2. Imprimer en 3D le négatif du moule d'échafaudage à l'aide de la technologie SLA de bureau
Le modèle CAO est imprimé en 3D dans le laboratoire du Dr Pashneh-Tala à l’aide de son imprimante SLA Formlabs et de Grey Resin. L’alternative serait d’envoyer le modèle à un fournisseur de services tiers pour qu’il soit imprimé en 3D ou usiné. Cela ajouterait des semaines au cycle de développement des vaisseaux et rendrait finalement la recherche impossible au sein de son laboratoire.
3. Mouler les négatifs des moules imprimés en 3D avec du silicone et les polymériser pour obtenir les moules d'échafaudage.
Les négatifs des moules imprimés en 3D sont alors moulés en silicone. Le silicone est ensuite polymérisé dans un four à 60°C puis retiré. Ceci produit les moules en silicone qui seront utilisés pour former l'échafaudage.

4. Assembler les moules d'échafaudage en silicone
Plusieurs moules en silicone sont assemblés pour produire la forme correcte de l’échafaudage. Des moules en silicone sont nécessaires pour façonner la surface extérieure de l'échafaudage et également pour produire le canal (lumen) qui traversera son centre.
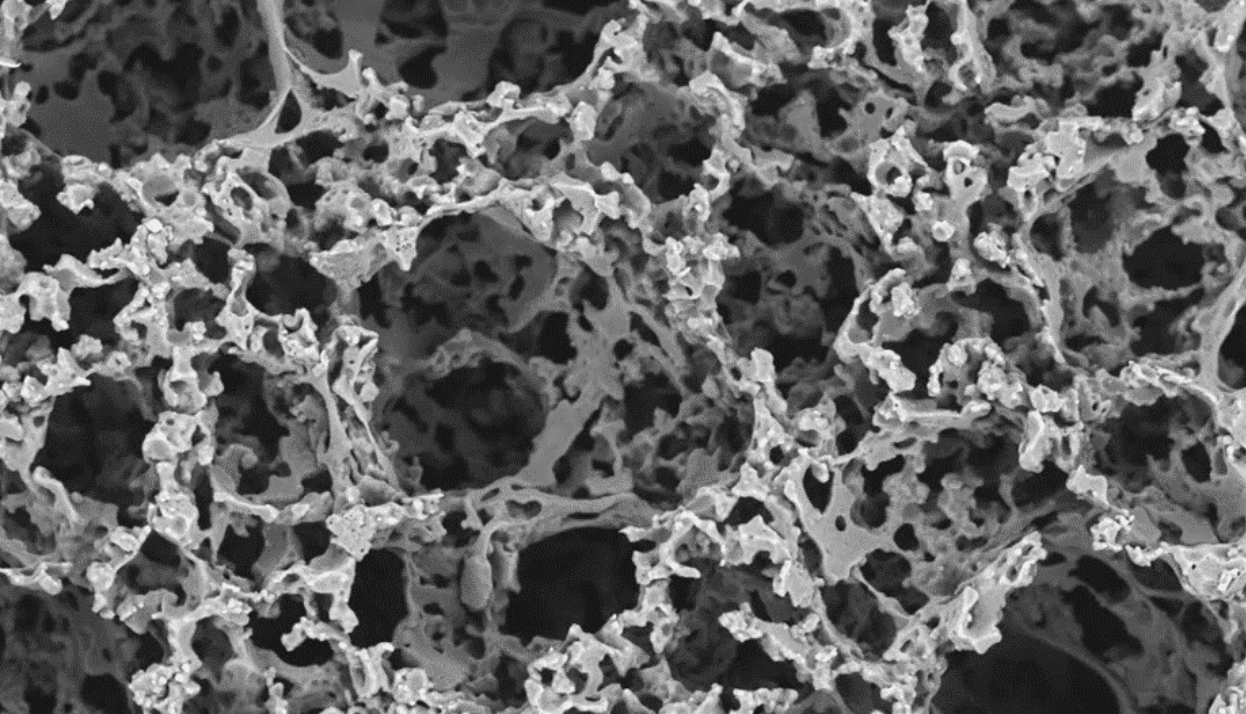
5. Injecter le matériau d'échafaudage (émulsion polymère biodégradable) et photopolymériser pour créer un échafaudage solide et poreux
La cavité du moule est remplie d'une émulsion polymère biodégradable qui a été spécialement développée à l'Université de Sheffield par le Dr Pashneh-Tala et son équipe. Ce polymère souple et biocompatible, dont le nom est abrégé en PGS-M, est idéal pour la culture des cellules. Le PGS-M est également photopolymérisable, ce qui permet de transformer l’émulsion de polymère liquide en un solide lorsqu’elle est exposée à la lumière UV. Après photopolymérisation, le moule est ouvert pour révéler un échafaudage poreux doté de trous microscopiques qui permettra aux cellules de s'y développer pendant la culture in vitro.
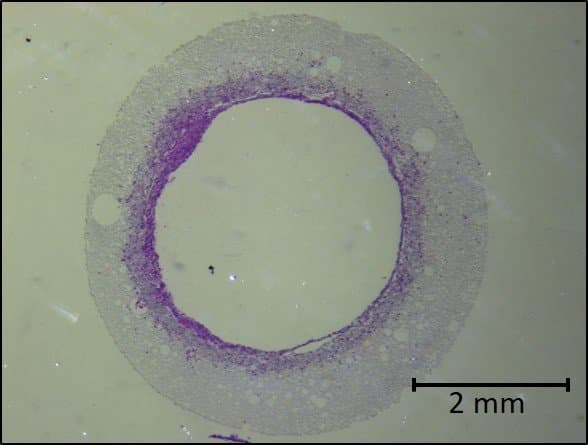
6. Stériliser l'échafaudage et l'ensemencer avec des cellules
Enfin, après la stérilisation, le Dr Pashneh-Tala cultive les cellules autour de l'échafaudage. Au fil du temps, la structure de l’échafaudage se dégradera et disparaîtra, ne laissant que les cellules dans la forme souhaitée.
Le Dr Pashneh-Tala a récemment commencé à explorer les possibilités d’utilisation de la résine Formlabs Elastic Resin en remplacement du silicone moulé, et ce dans le but de produire des moules directement utilisés pour fabriquer les échafaudages, en simplifiant le processus de fabrication et en réduisant le temps de développement.
Impression 3D d'une chambre de bioréacteur pour la culture d'une aorte fabriquée grâce au génie tissulaire.
Une fois que l'échafaudage de génie tissulaire a été ensemencé avec des cellules, il doit être cultivé en laboratoire afin de devenir le tissu requis. Ce processus est effectué à l'intérieur d'un bioréacteur, une chambre qui contient le tissu en développement et peut reproduire l'environnement interne du corps.
Imiter les facteurs environnementaux du corps est essentiel pour garantir le succès de la culture tissulaire en laboratoire. Le bioréacteur contient un milieu de croissance liquide qui nourrit les cellules du tissu en développement, tout comme le sang. Le bioréacteur est utilisé dans un incubateur reproduisant la température naturelle du corps à 37 °C. Il confine également le tissu dans un environnement stérile, exempt d’infection ou de contamination.
Pour le développement optimal des vaisseaux sanguins en ingénierie tissulaire, il est également important de recréer l’environnement mécanique des vaisseaux dans le corps. Pour imiter le flux sanguin, le milieu de croissance liquide est pompé à travers les vaisseaux en développement. Cela étire cycliquement les vaisseaux et les cellules qui les composent, assurant ainsi la production des protéines structurelles nécessaires à la formation d'un vaisseau sanguin. À la fin de la culture en bioréacteur, les vaisseaux sanguins mis au point sont prêts à être testés et, espérons-le, pourront être un jour implantés sur des patients.
Le Dr Pashneh-Tala utilise également son imprimante Form 2 (SLA) pour fabriquer les composants de ses bioréacteurs et a récemment commencé à produire des chambres complètes en utilisant cette méthode. Ce faisant, il est capable d'itérer rapidement des conceptions basées sur le tissu qu'il crée et d'imprimer des composants dans son laboratoire en quelques heures, ce qui permet de réduire les coûts et les délais de développement.

« Avant, j'aurais payé entre 314 et 350 € pour sous-traiter la fabrication d'une chambre de bioréacteur en polycarbonate. Avec ma Form 2, je peux imprimer le modèle dans mon laboratoire en utilisant Dental SG Resin, un matériau biocompatible et autoclavable, pour un prix compris entre 35 et 45 €. La chambre est ensuite facilement stérilisée et prête à être utilisée immédiatement. »
Dr Sam Pashneh-Tala, Chercheur, Université de Sheffield
L’accès à la fabrication de bureau permet également au Dr Pashneh-Tala de collaborer au niveau international sur la conception de ses bioréacteurs. En travaillant avec Aptus Bioreactors, experts dans la conception et la fabrication de systèmes de bioréacteurs en ingénierie tissulaire, le Dr Pashneh-Tala développe un système de culture de valvules veineuses en ingénierie tissulaire afin de proposer un traitement révolutionnaire de l'insuffisance veineuse profonde chronique.
Bien qu’Aptus soit basé en Caroline du Sud aux États-Unis et que le laboratoire du Dr Pashneh-Tala se trouve à l’Université de Sheffield au Royaume-Uni, ils utilisent tous deux des imprimantes 3D de bureau Formlabs dans leurs laboratoires. Cela permet aux composants du bioréacteur d'être conçus, imprimés en 3D et testés par Aptus, puis partagés numériquement avec le Dr Pashneh-Tala pour impression dans son laboratoire. Le Dr Pashneh-Tala est également en mesure de tester les composants, de les modifier au besoin et de les renvoyer numériquement à Aptus. Cette approche rationalisée tire parti des capacités de fabrication numérique et permet une collaboration transparente et une itération rapide des concepts sur deux continents.

« Le monde devient de plus en plus petit et de plus en plus connecté. L’accès accru aux technologies de fabrication numérique, telles que l’impression 3D, transforme la façon dont les groupes interagissent et collaborent sur des projets. En concevant conjointement des composants, en partageant des fichiers numériques pour les imprimer localement et en effectuant les tests nécessaires, chaque groupe peut se concentrer sur les tâches auxquelles il est le plus apte. Cela a permis à Aptus Bioreactors de gagner un temps précieux et d’économiser de l'argent en n’ayant pas à expédier des composants entre plusieurs sites et en permettant des collaborations et des développements qui, autrement, auraient pu être trop restrictifs en termes de coûts. »
Lee Sierad, fondateur et président, Aptus Bioreactors
La vision du Dr Pashneh-Tala est de produire de manière rapide et fiable des greffons vasculaires sur mesure, conçus pour s’adapter à chaque patient. Ces modèles seront générés à l'aide de données de numérisation cliniques, puis fabriqués à l'aide d'échafaudages et de bioréacteurs produits avec la technologie d'impression 3D. Les vaisseaux fabriqués par ingénierie tissulaire seront produits à l'aide de cellules prélevées chez le patient, évitant ainsi le risque de rejet par le système immunitaire après l'implantation.

L'avenir de l'impression 3D des dispositifs médicaux
Bien que la bio-impression d’organes internes entièrement fonctionnels tels que des cœurs, reins ou foie nécessite encore du temps, les progrès des techniques d'impression 3D hybrides se surviennent à un rythme très rapide. Les technologies d'impression SLA précises et abordables démocratisent la phase de recherche, permettent la fabrication rapide de dispositifs personnalisés et la mise au point de nouvelles solutions cliniques. L’élargissement de l’accès à des méthodes de production d’impression 3D de haute qualité permettra également de proposer ces nouveaux traitements à travers le monde.
« L’impression 3D sera une technologie clé dans l’avenir des soins de santé, car elle contribuera à l’offre d’une médecine personnalisée. Chaque corps est différent et la polyvalence de l’impression 3D convient parfaitement à ces différences. La qualité, l'économie et la gamme de matériaux disponibles via Formlabs me permettent de développer des solutions comme jamais auparavant. »
Dr Sam Pashneh-Tala, Chercheur, Université de Sheffield
Les systèmes d'impression 3D de Formlabs ont été utilisés et commentés dans divers projets de recherche menés par les communautés scientifique, médicale et dentaire. Découvrez-en davantage sur les applications médicales de l'impression 3D ou demandez un échantillon gratuit imprimé en 3D pour évaluer la qualité de l'impression SLA.